- Метод Мора
- Определение хлоридов методом Мора
- Фармацевтическая химия
- Аргентометрия
- Метод Мора. Прямая аргентометрия .
- Метод Фаянса. Прямая аргентометрия .
- Метод Фольдгарда . Обратная аргентометрия .
- Метод Кальтгофа – Стенглера . /Только для Br – /
- Метод Кальтгофа (Йодкрахмальный). / Для I – в присутствии Cl – и Br – /
- Аргентометрия с внешним индикатором. /Для I – /
- Аргентометрическое титрование
Метод Мора



Метод Мора является одним из аргентометрических методов. Все эти методы основаны на реакции:
Аg + + Наl — → АgНаl↓
Метод Мора является наиболее простым из всех методов аргентометрии и в то же время достаточно точным. Титрантом является раствор нитрата серебра АgNОз 0.1 моль/л.
В основу метода Мора положена реакция взаимодействия ионов серебра с С1 — или Вг — .
Индикатором является хромат калия К2СгО4 5 %. Установочным веществом для определения титра раствора является NаС1 или КС1 0.1 моль/л.
Метод Мора позволяет определить количество хлоридов или бромидов. Иодиды этим методом не определяют, так как выпадающий в осадок иодид серебра АgI сильно адсорбирует К2СгО4, поэтому точку эквивалентности определить невозможно.
Растворимость АgСl значительно меньше, чем растворимость Аg2СгO4. Поэтому если постепенно добавлять раствор АgNOз к раствору, содержащему Сl — и CrO4 2- , то ПРAgС| достигается раньше ПР Аg2СгO4.
Это означает, что вначале образуется труднорастворимая соль
После того как хлорид-ионы будут практически полностью выделены в виде АgС1, появляется осадок. Происходит изменение окраски титруемой смеси и таким образом определяется конец титрования.
При титровании раствора бромида происходит аналогичное явление. Так как ПРАgВг + + 2OH — → Ag2O↓ + H2O
2. Определение нельзя проводить в присутствии ионов Ва 2+ , Вi 3+ , Рb 2+ , так как эти ионы образуют с ионами СгО4 2 — осадки.
3. Титрование всегда ведут от галогенида к АgNOз (т. е. галогенид титруют раствором АgNОз, а не наоборот). Только при таком условии кирпично-красный осадок Аg2СгО4 образуется в точке эквивалентности.
Метод Мора находит широкое применение при анализе пищевых продуктов. Количество поваренной соли в колбасе, соленой рыбе, масле и других продуктах определяют по методу Мора.
Этот метод применяется также для определения хлоридов в воде. Метод Мора используется и при анализе некоторых фармацевтических препаратов, например хлоридов и бромидов натрия и калия.
Определение хлоридов методом Мора
Приготовление титранта 0.05 моль/л раствора. Нитрат серебра не относится к тем веществам, из которых можно приготовить раствор заданной концентрации по точно взятой навеске. Поэтому готовят раствор примерно требуемой концентрации, а его титр устанавливают. Необходимую навеску (8.5 г AgNОз на 1 л раствора) отвешивают с точностью до 0.1 г на технических весах, и нужное количество воды отмеривают мерным цилиндром. Раствор сохраняют в темноте, так как на свету нитрат серебра разлагается. Однако и при надлежащем хранении титр раствора АgNОз меняется с течением времени и его необходимо время от времени проверять.
Приготовление установочного раствора. Для приготовления 0.05 моль/л, раствора NаС1 отвешивают на аналитических весах 0.2922 г NаС1 и количественно переносят в мерную колбу вместимостью 100 мл. Растворяют навеску в дистиллированной воде, доводят раствор до метки и хорошо перемешивают. Таким образом получают раствор NаС1.
Определение титра нитрата серебра. В качестве индикатора применяют 5 % раствор хромата калия К2СгО4 в воде. Наполняют бюретку раствором нитрата серебра АgNОз. Отобрав пипеткой 10 мл 0.05 моль/л раствора NаС1, переносят ее в колбу Эрленмейера вместимостью 250 мл, добавляют 0.5 мл раствора индикатора, немного разбавляют водой и медленно титруют 0.1 моль/л раствором АgNОз, непрерывно перемешивая жидкость до появления первого неисчезающего изменения цвета суспензии. Нужно уловить момент, когда лимонно-желтый цвет суспензии приобретет от капли АgNОз слегка красноватый оттенок. Запись анализа и расчеты производят так же, как при определениях кислотно-основным методом.

Определение хлорида в растворе. Раствор хлорида помещают в мерную колбу на 100 мл, доводят дистиллированной водой до метки и перемешивают. Для титрования отбирают в коническую колбу 10 мл полученного раствора, немного разбавляют водой, добавляют 0.5 мл раствора К2СгO4 и титруют раствором АgNОз до изменения окраски содержимого колбы из лимонно-желтой в желто-розовую. Рассчитывают содержание хлора в полученном растворе (в граммах).
Источник
Фармацевтическая химия
SHAPE \* MERGEFORMAT
Аргентометрия
Метод Мора. Прямая аргентометрия .
Только для Cl – , Br – ; (не исп для I – ).
Титрант – AgNO 3 , индикатор – K 2 CrO 4 , среда: pH =6–8.
NaBr + AgNO 3 → AgBr ↓ + NaNO 3 ,
f экв ( NaBr )=1, 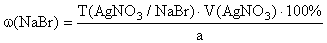
рН >8: 2 Ag + + 2 OH – → Ag 2 O + H 2 O .
Присутствие ионов : SO4 2– , S 2– , PO4 3– , AsO3 3– , BO3 3– , CO3 2– ; Bi 3+ , Ba 2+ , Pb 2+ .
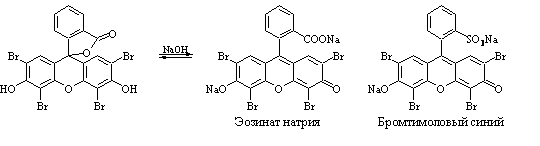
Метод Фаянса. Прямая аргентометрия .
Титрант – AgNO 3 , индикаторы – эозинат натрия ( Br – , I – ), бромтимоловый синий ( Cl – ), среда – CH 3 COOH (30%).
SHAPE \* MERGEFORMAT
NaI + AgNO 3 → AgI ↓ + NaNO 3 .
Йодид серебра адсорбирует на себе одноименные ионы; появляется ярко-розовая окраска:
В точке эквивалентности коллоидная частица становится электронейтральной , в КТТ начинает адсорбировать Ag + ; идет перезарядка мицеллы, осадок коагулирует, раствор просветляется:
< m ( AgI )∙ n I – ( n – x ) K + > x – ∙ x Ag + + Ind 2– → ( x /2) Ag 2 Ind + < m ( AgI )∙ n I – ( n – x ) K + > x – .
f экв ( NaI )=1, 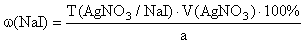
Метод Фольдгарда . Обратная аргентометрия .
Титранты – 1) AgNO 3 , 2) NH 4 SCN ;
Среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , точный избыточный объем AgNO 3 и индикатор:
KBr + AgNO 3 → AgBr ↓ + KNO 3 ,
В КТТ индикатор взаимодействует с титрантом :
f экв ( KI )=1, 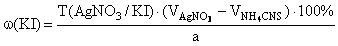
Преимущества пред другими методами:
1. Сильнокислая среда,
2. Не мешают друг ие ио ны;
1. Меньшая точность (обратный метод),
Особенности титрования хлоридов:
1. Низкая скорость титрования [ Ks ( AgCl )> Ks ( AgCNS )],
2. Очень слабое перемешивание,
3. Добавление толуола или бензола для экстракции AgCl .
Особенности титрования йодидов:
После добавления нитрата серебра ждут полного осаждения AgI , второй индикатор добавляют перед самым титрованием:
Метод Кальтгофа – Стенглера . /Только для Br – /
Титранты – 1) AgNO 3 , 2) NH 4 SCN , индикатор – NH 4 Fe ( SO 4 )2, среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , индикатор и точный избыточный объем NH 4 SCN (0,1 мл):
Титруют нитратом серебра до исчезновения красного окрашивания:
KBr + AgNO 3 → AgBr ↓ + KNO 3,
f экв ( KBr )=1, 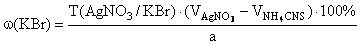
Метод Кальтгофа (Йодкрахмальный). / Для I – в присутствии Cl – и Br – /
Титрант – AgNO 3 , индикатор – крахмал, среда – H 2 SO 4 .
К ратсвору навески препарата прибавляют 1 каплю KIO 3 (0,1 моль/л), раствор крахмала и H 2 SO 4 (1:5) до появления синего окрашивания:
Титруют AgNO 3 (0,1 моль/л) до исчезновения синего окрашивания (после удаления йодида):
f экв ( KI )=1, 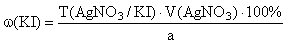
Аргентометрия с внешним индикатором. /Для I – /
Титрант – AgNO 3 , индикатор – нитриткрахмальная бумага, среда – H 2 SO 4 .
К раствору навески препарата добавляют H 2 SO 4 (1:5), титруют AgNO 3 . Вблизи точки эквивалентности после каждого раза прибавления титранта наносят каплю раствора на нитриткрахмальную бумагу. Титрование заканчивают, когда синего окрашивания на бумаге от прибавления раствора не будет:
f экв ( NaI )=1, 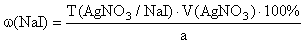
Источник
Аргентометрическое титрование
Аргентометрический титриметрический метод анализа основан на применении в качестве осадителя стандартного раствора серебра нитрата:
Аg + + Наl — ↔ АgНаl↓
Стандартный раствор 0,1 моль/дм 3 серебра нитрата может быть приготовлен:
— как первичный стандартный раствор;
— вторичный стандартный раствор.
Для приготовления первичного стандартного 0,1 моль/дм 3 раствора AgNО3 рассчитанную навеску химически чистой соли AgNО3 взвешивают на аналитических весах, переносят в мерную колбу, растворяют в дистиллированной воде, доводят объем раствора до метки, тщательно перемешивают и переносят в склянку из темного стекла.
При приготовлении вторичного стандартного раствора АgNО3 рассчитанную навеску соли взвешивают на технических весах, переносят через воронку в склянку из темного стекла, добавляют цилиндром необходимый объем дистиллированной воды и тщательно перемешивают. Полученный вторичный стандартный раствор AgNО3 стандартизуют по химически чистым стандартным веществам KCl или NaCl или же по их растворам.
Концентрация стандартных растворов серебра нитрата изменяется при длительном хранении. Причиной нестойкости растворов серебра нитрата является их светочувствительность, потому эти растворы следует хранить в склянках из темного стекла либо в посуде, обернутой черной бумагой или покрытой черным лаком, и в защищенном от света месте. Их концентрацию необходимо периодически проверять.
Способы определения конечной точки титрования
В методе аргентометрии используют как безындикаторные, так и индикаторные способы фиксирования конечной точки титрования.
Хлорид — ионы определяют по так называемому способу равного помутнения (метод Гей-Люссака). При этом анализируемый раствор титруют стандартным раствором серебра нитрата, конец титрования определяют путем отбора двух проб титруемого раствора в две пробирки вблизи конечной точки титрования: в одну из них прибавляют каплю стандартного раствора серебра нитрата, в другую – каплю стандартного раствора натрия хлорида такой же концентрации. В недотитрованном растворе появляется помутнение в пробирке с серебра нитратом, в перетитрованном — в пробирке с натрия хлоридом. В конечной точке титрования раствор в обеих пробирках имеет одинаковое помутнение.
Бромид- и йодид- ионы определяют безындикаторным способом просветления. Суть его состоит в том, что при добавлении к анализируемому раствору из бюретки небольшими порциями стандартного раствора серебра нитрата в начале образуется коллоидный раствор серебра бромида, а в момент эквивалентности происходят коагуляция коллоидных частиц и осаждение их в виде творожистых хлопьев, раствор при этом осветляется. Этот метод достаточно точен, но в настоящее время применяется редко.
Из современных безындикаторных методов в аргентометрии чаще всего применяется потенциометрическое определение точки эквивалентности с использованием серебряных или галогенид-селективных электродов.
Подбор индикаторов в аргентометрии очень сложен. Для его выполнения, как и в кислотно-основном методе титрования, используют кривую титрования, представляющую собой графическое изображение изменения концентрации определяемых ионов в конце титрования, то есть когда недотитровано 10 % определяемого вещества и когда раствор перетитрован стандартным раствором на 10 %.
Вначале рСl изменяется медленно и лишь вблизи точки эквивалентности — скачкообразно. Резкое изменение pCl вблизи точки эквивалентности называется скачком титрования. Скачок титрования начинается, когда недотитровано 0,1 % NaCl, и заканчивается, когда раствор перетитрован на 0,1 %. Общая величина скачка титрования -2 ед. рСl. Кривая титрования симметрична относительно точки эквивалентности ТЭКВ.
Выбор индикатора по кривой титрования. При выборе индикатора выбирают такой ион, который образует окрашенное соединение с ионом серебра в пределах скачка титрования, то есть при рАg = 4. 6 ед. наиболее пригодным оказывается K2CrО4, т. к. Ks = 2,1*10 -12 и анион CrO4 2- образуют кирпично-красный осадок серебра хромата, что укажет на конец титрования.
В зависимости от применяемого индикатора в аргентометрии различают следующие методы (таблица 1):
—метод Мора, основанный на реакции между ионами серебра и галогенид — ионами в присутствии индикатора — раствора калия хромата;
—метод Фольгарда(тиоцианатометрия), основанный на реакции между ионами серебра и тиоцианат-ионами в присутствии ионов железа (III) в качестве индикатора;
— метод Фаянса — Ходакова основан на применении адсорбционных индикаторов.
Способы индикации конца титрования осадительном титровании
| Метод | Индикатор | Принцип действия индикатора | Определяемые ионы |
| Гей-Люссака | Безиндикаторный | Титрование до просветления, т.е. когда новая порция титранта не вызывает помутнения раствора | Br — |
| Мора | K2Cr2O7 | Появление в щелочной среде кирпичного цвета осадка Ag2CrO4 при избытке титранта | Cl — , Br — |
| Фольгарта | FeCl3 | Появление красного окрашивания при избытке раствора NH4CNS в качестве титранта | Ag+ (прямое титрование); Cl — , CN — , CrO4 2- , CO3 2- , PO4 3 — и др. (обратное титрование) |
| Фаянса | Адсорбционные индикаторы (эозин, флюоресцин) | Адсорбция индикатора на осадке при избытке титранта и изменении окраски осадка | Br-, Cl-, I-, SeO32 |
Метод Мора.
Титрантом метода является раствор 0,1 (или 0,05; 0,02; 0,01) моль/дм 3 серебра нитрата. В качестве индикатора используют раствор 0,01 моль/дм 3 калия хромата, применение которого основано на дробном осаждении. Суть метода заключается в том, что при титровании галогенид-ионов в присутствии хромат-ионов в первую очередь осаждаются галогенид-ионы:
Hal — + Ag + ↔ AgHal↓
Когда определяемые галогенид-ионы практически полностью осаждаются в виде AgHal, только тогда начинает выпадать кирпично-красный осадок Ag2СrО4:
Это обусловлено различной растворимостью солей АgНаl и Ag2CrO4↓.
Условия титрования по методу Мора:
1. Титрование следует проводить в нейтральной или слабощелочной среде (6,5≤ рН≤ 10). Метод нельзя применять:
а) в кислой среде из-за растворяемости осадка Ag2CrО4:
б) в щелочной среде из-за разложения титранта с образованием осадка Аg2О:
2Ag + + 2ОН — ↔ 2AgOH↓ → Аg2О↓ + Н2О
2. В растворе должны отсутствовать:
а) катионы Рb2 + , Ва2 + , Hg2 + и другие, образующие с анионами индикатора осадки хроматов:
б) анионы PO4 3- , CO3 2- , C2О4 2- , AsО4 3- и другие, образующие осадки с ионами серебра:
3. Вблизи конечной точки титрования раствор необходимо титровать медленно, при энергичном перемешивании, чтобы уменьшить ошибку за счет адсорбции.
4.Нельзя титровать окрашенные растворы, так как они будут маскировать окраску AgCrO4, что затруднит фиксирование конечной точки титрования.
Метод Мора применим для определения хлоридов и бромидов, в том числе фармацевтических препаратов, в состав которых входят хлорид- и бромид- ионы.
Метод Мора нельзя использовать для определения:
— йодид- и роданид-ионов из-за их сильной адсорбции на поверхности осадка;
— солей галоидоводородных кислот и слабых оснований, так как в peзультате гидролиза в их растворах образуется кислая среда:
Метод Фольгарда.
(тиоцианатометрия, роданометрия)
Метод Фольгарда основан на титровании раствора, содержащего ионы серебра, стандартными растворами NH4NCS или KNCS:
Ag + + NCS — ↔ AgNCS↓
Индикатором в этом методе являются ионы Fe 3+ . После осаждения ионов серебра в виде белого осадка AgNCS избыточная капля титранта реагирует с индикатором — раствором железоаммонийных квасцов NH4[Fe(SO4)2] ∙12Н2О с образованием растворимого красного комплекса:
Ионы Fe 3+ образуют с NCS — -ионами окрашенные комплексы различного состава: [Fe(NCS)] 2+ , [Fe(NCS)2] + ∙ [Fе(NСS)6] 3- и другие, но образование комплексов различного состава не влияет на результаты титрования, так как все комплексы окрашены.
При определении по методу Фольгарда применяют прямое и обратное титрование. В качестве стандартных растворов используют:
а) в методе прямого титрования — растворы аммония тиоцианата или калия тиоцианата;
б) в методе обратного титрования — растворы серебра нитрата и аммония или калия тиоцианата.
Приготовление раствора NH4NCS. Аммония тиоцианат не являяется стандapтным веществом, так как соль гигроскопична. Поэтому из нее готовят раствор требуемой концентрации — приблизительно 0,1 или 0,05 моль/дм 3 , а затем его стандартизуют по стандартному веществу AgNО3 или по стандартному раствору АgNО3.
Условия титрования по методу Фольгарда:
1. Титрование следует выполнять в кислой среде для предотвра-щения гидролиза индикатора — ионов Fe 3+ :
Fe 3+ + Н2О ↔ FeOH 2+ + Н +
2. При титровании раствор необходимо энергично перемешивать для уменьшения ошибки за счет адсорбции ионов на поверхности осадка.
3. В анализируемом растворе должны отсутствовать:
а) соли ртути (1) и (II), реагирующие с NCS — -ионами:
б) окислители КвrО3, КМnO4 и другие, окисляющие NСS-ионы;
в) анионы F — , PO4 3- , C2О4 2- и другие, образующие прочные комплексы с индикатором:
Определение ионов Ag + по методу Фольгарда (прямое титрование)
Концентрацию ионов серебра определяют прямым титрованием стандартным раствором аммония тиоцианата (или калия тиоциа-ната) в присутствии ионов Fe 3+ .
Стандартный раствор аммония тиоцианата реагирует в первую очередь с ионами серебра, образуя малорастворимое соединение:
Ag + + NCS — ↔ AgNCS KS(AgNCS) = 1,1 ∙ 10 -12
В конечной точке титрования избыточная капля титранта реагирует с ионами Fе 3+ и окрашивает раствор в красный цвет:
Fe 3+ + 3NCS — ↔ [Fе(NСS)3] Кнест = 4 ∙10 -2
Метод Фольгарда (прямое титрование) применяют для опредния:
а) содержания серебра в сплавах (предварительно растворив его точную навеску в азотной кислоте);
б) катионов серебра в коллоидных растворах (колларголе и протар-голе);
в) концентрации солей ртути (II).
Определение анионов по методу Фольгарда (обратное титрование)
Для определения анионов используется обратное титрование. Суть определения состоит в том, что к анализируемому раствору прибавляют удвоенный минимальный, точно отмеренный объем (35,00 или 40,00 см 3 ) стандартного раствора серебра нитрата ( l-й титрант), который реагирует с определяемыми анионами, например хлорид-ионами:
Непрореагировавший остаток серебра нитрата оттитровывают вторым стандартным раствором аммония тиоцианата в присутствии индикатора ионов Fe 3+ :
Ag + + NCS — ↔ AgNCS↓
в конце титрования избыточная капля раствора NH4NCS реагирует с ионами Fe 3+ :
и раствор окрашивается в красный цвет.
При определении хлоридов возникает ошибка за счет нечеткого установления конечной точки титрования. Это связано с протеканием обменной реакции между осадком серебра хлорида и тиоцианат-ионами в растворе, так как осадок серебра тиоцианата менее растворим, чем осадок AgCl:
AgCl + NCS — ↔ AgNCS + Сl —
KS(AgCl) = 1,78 ∙10 -10 ; KS(AgNCS) = 1,1∙10 -12
Это приводит к значительному перерасходу титранта NH4NCS, и результаты определения будут завышены. Для устранения этой методической ошибки осадок АgСl отфильтровывают и в полученном фильтрате определяют избыток серебра нитрата. Этот способ усложняет работу.
По методу Фольгарда можно определить:
а) катионы Ag + — прямым титрованием;
б) анионы Сl, Вr — , I, NCS — — обратным титрованием.
По сравнению с методом Мора метод Фольгарда имеет ряд преимуществ:
— определение Ag + , Сl, Вr — , I — , NCS — выполняют в кислой среде;
— катионы Ва 2+ , Pb 2+ и другие, мешающие определению анионов по методу Мора, не мешают их определению по Фольгарду.
Источник