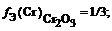Фактор эквивалентности для соли мора
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н + или ОН – , в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н + (кислота проявляет основность 2). Тогда по определению эквивалентом H 3 PO 4 будет являться условная частица 1/2 H 3 PO 4, т.к. если одна молекула H 3 PO 4 предоставляет два иона Н + , то один ион Н + дает половина молекулы H 3 PO 4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН – , следовательно, один ион ОН – потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности ( f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
f Э (формульная единица вещества) º эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H 3 PO 4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
Фактор эквивалентности
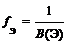
где В(Э) – валентность элемента
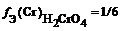
Простое вещество
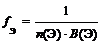
где n (Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
f Э (O3) = 1/(3 × 2) = 1/6
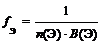
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
f Э (P2O5) = 1/(2 × 5) = 1/10
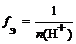
где n ( H + ) – число отданных в ходе реакции ионов водорода (основность кислоты)
f Э ( H 2 SO 4 ) = 1/1 = 1 (основность равна 1)
(основность равна 2)
Основание
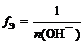
где n (О H – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
f Э ( Cu ( OH )2) = 1/1 = 1 (кислотность равна 1) или
(кислотность равна 2)
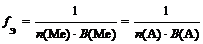
где n (Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n (А) – число кислотных остатков, В(А) – валентность кислотного остатка
f Э ( Cr 2 ( SO 4 )3) = 1/(3 × 2) = 1/6 (расчет по кислотному остатку)
Частица в окислительно-восстановительных реакциях
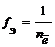
где 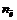
Fe 2+ + 2 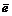
MnO4 – + 8H + + 5 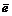
f Э ( MnO 4 – ) = 1/5
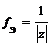
где z – заряд иона
f Э ( SO 4 2– ) = 1/2
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl 2, б) КНСО3, в) ( MgOH )2 SO 4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl 2 (средняя соль):
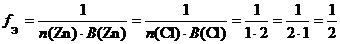
f Э( ZnCl 2) = 1/2, поэтому эквивалентом ZnCl 2 является частица 1/2 ZnCl 2.
б) КНСО3 (кислая соль):
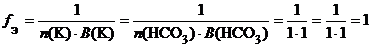
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) ( MgOH )2 SO 4 (основная соль):
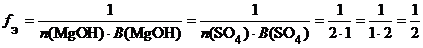
f Э ( ( MgOH )2 SO 4 ) = 1/2, поэтому эквивалентом ( MgOH )2 SO 4 является частица 1/2( MgOH )2 SO 4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества n э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
МЭ = М × f Э.
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей , например:
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента ( 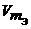
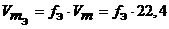
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам . Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
n э(реагента1) = … = n э(реагента n ) = n э (продукта1) = … = n э (продукта n )
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
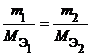
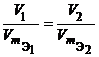
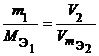
где m 1 и m 2 – массы реагентов и (или) продуктов реакции , г ;
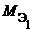
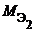
V 1, V 2 – объемы реагентов и (или) продуктов реакции , л ;
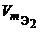
Источник
Тема. Оксидиметрия. Перманганатометрия
Лабораторная работа 9 (вариант 1)
Цель работы: Определить массу Fe2+ в растворе двойной соли ( NH 4)2 Fe ( SO 4)2 – соли Мора.
т. к. Fe2+ отдает 1 электрон, то M экв соли Мора = Мсоли Мора = 392,14 г/моль.
- Соль Мора – сульфат аммоний-железа ( II ) — (NH 4)2Fe (SO 4)2 – кристаллический Оксалат натрия Na 2 C 2 O 4 , 0,1 н раствор – из фиксанала Вода дистиллированная Серная кислота H 2SO4 , 2 н раствор Перманганат калия KMnO4 , кристаллический
Посуда и приборы:
- Бюкс или чашка Петри для взвешивания Весы аналитические Мерная колба (100 мл) Мерная колба (250 мл) Цилиндр мерный (50 или 100 мл) Пипетка (20 мл) Колба коническая для титрования (100 мл) – 4 шт Бюретка для титрования (25 мл) Электроплитка Асбестовая сетка
1. Приготовление 250 мл 0,1 н раствора KMnO 4 и установление его концентрации.
1.1 Расчет приблизительной навески 
Рассчитанную навеску KMnO 4 взвесить на аналитических весах и количественно перенести в мерную колбу вместимостью 250 мл, в которую предварительно налито небольшое количество дистиллированной воды. Навеску растворить, довести объем в колбе до метки дистиллированной водой. Содержимое колбы тщательно перемешать.
1.3 Установление точной молярной концентрации эквивалента (нормальной концентрации) приготовленного раствора по 0,1 н раствору 

B конической колбе вместимостью 100 мл нагреть 30 мл 2 н 







NB ! Титруемый раствор 
Молярную концентрацию эквивалента (нормальную концентрацию) раствора 


2. Определение массы ионов Fe2+ в растворе двойной соли ( NH 4)2 Fe ( SO 4)2 – соли Мора.
Навеску 1,3 — 1,5 r растертой соли Мора взвесить c точностью до 0,0001 r, перенести в мерную колбу на 100 мл, растворить в дистиллированной воде, подкисленной 30-40 мл 2 н 


1. Нормальная концентрация (молярная концентрация эквивалента) раствора соли Мора:
2. Масса ионов Fe2+ в исследуемом растворе:
m Fe2+ = CN соли Мора • М экв Fе2+ •Vмерной колбы = CN соли Мора •55,85 • 0,1 = CN соли Мора • 5,585 г
m Fe2+ = 5,585 • CN соли Мора
Задания.
1. Рассчитать массу Н2С2О4∙2Н2О, которую следует взять в мерную колбу вместимостью 500,0 мл, чтобы на титрование 25,00 мл полученного раствора израсходовать 20,25 мл раствора КМ nO 4 с концентрацией 3,2800 г/л.
2. Какую массу КМ nO 4 надо взять для приготовления: а) 500,0 мл 0.05 н. раствора ( f экв = 1/5) ; б) 500,0 мл раствора с Т(КМ nO 4 / Fe ) = 0,005932; в) 250,0 мл раствора с Т(КМ nO 4 / Са) = 0,005246? Во всех случаях предусматривается титрование в кислой среде.
Ответ: а) 0,7902 г; б) 1,6786 г; в) 1,0364 г
3. Какой объем 0,5000 н. КМ nO 4 ( f экв = 1/5) необходимо добавить к 500,0 мл раствора с Т(КМ nO 4 / Fe ) = 0,00280, чтобы получить растворы: а) с Т(КМ nO 4) = 0,004250; б) с Т(КМ nO 4 / Fe ) = 0,00400?
Ответ: а) 115,35 мл; б) 25,07 мл
4. Вычислить массовую долю (%) Н2С2О4∙2Н2О в техническом препарате щавелевой кислоты, если 0,2003 г её отттитровали 29,30 мл раствора КМ nO 4. Т(КМ nO 4 / Fe ) = 0,006023.
Источник