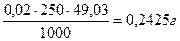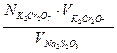Титрование соли мора по железу
- Главная Страница
- Поиск По Сайту
- Контакты Обратная связь
- Главная
- Химия
- Окислительно-восстановительное титрование
- Определение железа в растворе соли Мора
Определение железа в растворе соли Мора
Опыт 2. Определение железа (II) в растворе соли Мора.
Принцип метода. Титрование железа (II) основано на реакции:
5Fe2+ + MnO4-+ 8H+ ® 5Fe3+ + Mn2+ + 4H2O.
Если железо (II) входит в состав соли Мора (NH4)2SO4·FeSO4·6H2O, то идёт следующая реакция:
2KMnO4 + 10(NH4)2SO4·FeSO4 + 8H2SO4 ® 2MnSO4 + 5Fe2(SO4)3 + K2SO4 +
10 5 Fe2+ — e — ® Fe3 + 2 1 MnO4- + 8H+ + 5e — ® Mn2+ + 4H2O
Мэ(соли Мора) = М(соли Мора)
Реагенты и оборудование: стандартизованный 0,05 н раствор перманганата калия; раствор соли Мора; 2 н раствор серной кислоты; бюретка; стеклянная воронка; конические колбы ёмкостью 100 мл; пипетки Мора; стеклянный цилиндр ёмкостью 50 мл; мерная колба ёмкостью 100 мл.
Ход анализа. В мерную колбу ёмкостью 100 мл наливают немного раствора соли Мора, доводят объём дистиллированной водой до метки и перемешивают. Из этого раствора пипеткой Мора отбирают 10,00 мл и переносят в коническую колбу, добавляют 10 мл 2 н раствора серной кислоты. В чистую бюретку заливают раствор перманганата калия и подготавливают к титрованию. Титрование подкисленного раствора соли Мора перманганатом калия проводят на холоде (при нагревании катион железа (II) окисляется кислородом воздуха до катиона железа (III)) до появления бледно-малиновой окраски, не исчезающей при встряхивании в течение 1-2 минут. Повторяют титрование 2-3 раза.
Обработка результатов. Из сходящихся отсчётов берут средний результат титрования и вычисляют массу железа в анализируемом растворе.

Масса железа в 100 мл раствора соли Мора равна:
Источник
Определение содержания железа (II) в растворе соли Мора
Щавелевая кислота Н2С2О4·2Н2О; 0,02 н раствор ((первичный стандартный раствор) или оксалат натрия Na2С2О4; 0,02 н раствор); перманганат калия КМnО4 ,
0,02 н раствор, титрант (вторичный стандартный раствор);
Серная кислота Н2SО4, 4 н раствор.
1. Приготовление первичного стандартного раствора щавелевой
Стандартный раствор готовят из химически чистой перекристаллизованной щавелевой кислоты. Грамм-эквивалент щавелевой кислоты рассчитывают, исходя из реакции взаимодействия с перманганатом калия, протекающей по следующему ионно-электронному уравнению:
2 
 |
Следовательно, ЭМщ.к. =
Расчет навески для приготовления первичного стандартного раствора ведут по формуле:


где атеор. – навеска, г;
N – нормальность раствора, г-экв/л;
Vк – объем мерной колбы, мл;
Для приготовления 250 мл 0,02 н раствора щавелевой кислоты следует взять навеску:
атеор. =
Рассчитанное количество щавелевой кислоты взвешивают в бюксе сначала приблизительно на технических весах, а затем точно на аналитических весах.
Щавелевую кислоту через воронку количественно переносят в мерную колбу, растворяют в холодной дистиллированной воде, добавляют воды до метки и тщательно перемешивают. Пустой бюкс взвешивают также на аналитических весах.
Навеска определяется по разности двух взвешиваний (апракт.):
Вес бюкса с навеской — А (г)
Вес пустого бюкса — В (г)
 |
Нормальность приготовленного первичного стандартного раствора щавелевой кислоты вычисляют по формуле:
N = 
2. Установление концентрации раствора перманганата калия
Конценрацию раствора КМnО4 — устанавливают по первичному стандартному 0,02 н раствору щавелевой кислоты (или оксалата натрия). Раствор КМnО4 наливают в бюретку и устанавливают уровень жидкости на нуле по верхнему мениску (окрашенный раствор). В три конические колбы переносят пипеткой по 10 мл стандартного раствора щавелевой кислоты и добавляют мензуркой по 10 мл 4 н Н2SО4. Последовательно каждую из колб нагревают до 80-90º С и раствор медленно при непрерывном помешивании титруют раствором перманганата калия до появления бледно-розового окрашивания.
При титровании идет следующая реакция:
Практически эта реакция идет в несколько стадий. Нагревание и повышение концентрации ионов водорода способствует увеличению скорости взаимодействия перманганата с щавелевой кислотой. Ионы марганца (II) оказывает каталитическое действие на реакцию (автокатализ).
Во время титрования раствор перемешивают и каждую следующую каплю добавляют только после исчезновения окраски от предыдущей капли. Титрование проводят не менее 3-х раз до получения сходящихся результатов. Находят среднее значение, по которому рассчитывают точную концентрацию титранта (вторичного стандартного раствора) по формуле:
nщ.к. = n
Nщ.к. ·Vщ.к. = N 
N 

Т 

ЭМ 
3. Определение содержания железа (II) в растворе соли Мора
Полученный в мерной колбе на 100 мл анализируемый раствор соли Мора FeSO4(NH4)2SO4 · 6H2O (задача) разбавляют дистиллированной водой до метки и тщательно перемешивают. В три конические колбы отбирают пипеткой по 10 мл анализируемого раствора и добавляют мензуркой по 10 мл 4 н H2SO4. Полученную смесь перемешивают и титруют раствором перманганата калия до бледно-розового окрашивания. Для вычисления берут среднее значение объема титранта, пошедшего на титрование.
Реакция идет по следующему уравнению:

1 MnO — 4 + 8H + + 5e → Mn 2+ + 4H2O
 |
MnO — 4 + 5Fe 2+ + 8H + → Mn 2+ + 5Fe 3+ + 4H2O
Отсюда следует, что грамм – эквивалент соли Мора равен ее молекулярной массе.
По результатам титрования рассчитывают концентрацию анализируемого раствора и количество железа (II) в выданном растворе (100 мл) по следующим формулам:
nсоли Мора = n
Nсоли Мора . Vсоли Мора = N 
ЭМ – грамм – эквивалент железа
Vк– объем мерной колбы, мл.
ИОДОМЕТРИЯ
Основная реакция: J2 + 2e ↔ 2J —
| Первичный стандартный раствор исходного вещества | K2Cr2O7 – дихромат калия; 0,02 н. раствор Cr2O7 2- + 6e + 14H + → 2Cr 3+ + 7H2O E° 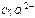 + 14H + / 2Cr 3+ + 7H2O = 1,36 В ЭМ = + 14H + / 2Cr 3+ + 7H2O = 1,36 В ЭМ =  |
| Вторичные стандартные растворы | 1.) Na2S2O3 · 5H2O – тиосульфат натрия; 0,02 н. раствор 2S2O 2- 3 – 2e → S4O6 2- ; E° |
| KJ – иодид калия; 0,1 М раствор KJ – вспомогательный раствор | |
| Фиксирование точки эквивалент-ности (ТЭ) | Специфический индикатор – крахмал, 5%-ный раствор Образует с иодом сине – черное окрашивание |
| Определяемые вещества | 1.) Окислители. Определяют методом замещения n 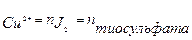 K2Cr2O7 + 6KJ+ 7H2SO4 → Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O J2 + 2Na2S2O3 → 2NaJ + Na2S4O6 3.) Восстановители. Определяют обратным титрования K2Cr2O7 + 6KJ+ 7H2SO4 → Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O J2 + 2Na2S2O3 → 2NaJ + Na2S4O6 3.) Восстановители. Определяют обратным титрования  Na2SO3 + J2 + H2O → 2HJ + Na2SO4 избыток J2 + 2Na2S2O3 → 2NaJ + Na2S4O6 Na2SO3 + J2 + H2O → 2HJ + Na2SO4 избыток J2 + 2Na2S2O3 → 2NaJ + Na2S4O6 |
ИОДОМЕТРИЯ
РАБОТА № 6
Определение содержания меди (II) в растворе
медного купороса
Дихромат калия K2Cr2O7; 0,02 н раствор (первичный стандартный раствор)
Тиосульфат натрия Na2S2O3 . 5H2O; 0,02 н раствор (вторичный стандарт- ный раствор, титрант).
Иодид калия KJ; 0,1 М раствор (вспомогательный раствор)
Серная кислота H2SO4; 1 М раствор
Индикатор — 5%-ный раствор крахмала.
1. Приготовление первичного стандартного раствора дихромата калия.
Стандартный раствор готовят из химически чистого перекристаллизированного K2Cr2O7. Грамм – эквивалент дихромата калия рассчитывают, исходя из реакции взаимодействия с иодидом калия, протекающей по следующему ионно – электронному уравнению:

 |
Следовательно, грамм – эквивалент K2Cr2O7 равен:
ЭМ
Для приготовления 250 мл 0,02 н. раствора K2Cr2O7 следует взять навеску:
атеор. =
Рассчитанное количество дихромата калия взвешивают в бюксе сначала на технических весах, а затем точно на аналитических весах, количественно переносят в мерную колбу, растворяют в холодной дистиллированной воде, добавляют воды до метки и тщательно перемешивают. Пустой бюкс взвешивают на аналитических весах; навеска апракт. определяется по разности взвешиваний.
Нормальность приготовленного первичного стандартного раствора дихромата калия вычисляется по формуле:
N =
2. Установление концентрации раствора тиосульфата натрия
Концентрацию раствора тиосульфата натрия Na2S2O3 . 5H2O устанавливают по первичному стандартному 0,02 н раствору дихромата калия, пользуясь методом замещения. Раствор тиосульфата натрия наливают в бюретку, устанавливают уровень жидкости на нуле по нижнему мениску.
В коническую колбу пипеткой переносят 10 мл раствора K2Cr2O7, прибавляют 10-15 мл 0,1 раствора иодида калия и 10 мл 1 М серной кислоты; смесь хорошо перемешивают. Колбу закрывают часовым стеклом, дают постоять в темноте около 4-5 минут и выделившийся иод титруют раствором тиосульфата. Когда бурая окраска выделившегося иода перейдет в соломенно-желтую, прибавляют 10 капель свежеприготовленного крахмала и продолжают титровать тиосульфатом натрия до перехода синей окраски в светло-зеленую. Титрование считается законченным, если синее окрашивание после окончания титрования не возвращается в течение 1 минуты. Титрование повторяют не менее 3-х раз. Результаты параллельных проб не должны отличаться друг от друга более чем на 0,1 мл. Вычисляют среднее значение объема титранта.

 |
 |
Из реакции (2) следует, что грамм-эквивалент тиосульфата натрия равен его молекулярной массе, т.е. 248,2.
При расчете концентрации титранта следует помнить, что взятое число мг-эквивалентов дихромата калия после реакции с иодидом калия выделяет равное количества мг-эквивалентов тиосульфата натрия, т.е.
N 




Исходя из этого соотношения, нормальность тиосульфата натрия вычисляют по формуле:
N 
T 
3. Определение содержания Cu(II) в растворе медного купороса
Полученный в мерной колбе емкостью 100 мл анализируемый раствор медного купороса CuSO4 . 5H2O разбавляют дистиллированной водой до метки и тщательно перемешивают.
В колбу для титрования пипеткой переносят 10 мл раствора медного купороса, цилиндром туда же наливают 10 мл 0,1 М раствора KY, 5 мл 1 м H2SO4 и, накрыв колбу часовым стеклом, ставят на 5 минут в затемненное место для завершения реакции.
Затем выделившийся иод титруют раствором тиосульфата натрия, не обращая внимания на осадок. Когда окраска раствора станет соломенно-желтой, прибавляют 10 капель крахмала и продолжают титровать до исчезновения синего цвета. Титрование повторяют 3 раза и из сходящихся результатов берут среднее значение.
Реакция идет по уравнению:

 |
Исходя из реакции следует, что грамм-эквивалент меди равен ее грамм-атому.
По результатам титрования рассчитывают концентрацию анализируемого раствора и количество Cu(II) в выданном растворе (100 мл) по следующим формулам:
n 


N 


QCu(II) = N 
где Q Cu(II) – содержание определяемого вещества, мг;
ЭМ – грамм-эквивалент меди (ЭМCu= 63,54)
Vк – объем мерной колбы, мл.
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ
А р г е н т о м е т р и я
Основная реакция: Ag + + Cl — =AgCl(т); Kпр = 1,1 . 10 -10
| Первичные стандарт-ные раст-воры ис-ходных ве-ществ | NaCl – хлорид натрия, х.ч.; 0,04 н. раствор ЭМ = Молек.масса = 58,443 |
| Вторич-ные стан-дартные растворы (титранты) | 1) AgNO3 – нитрат серебра, 0,05 н. раствор ЭМ = Молек.масса = 169,875 2) KSCN (или NH4SCN) – роданид калия, Источник |




 /
/  = + 0,09В ЭМ =
= + 0,09В ЭМ =  2.) J2 – иод, 0,02 н. раствор Е°
2.) J2 – иод, 0,02 н. раствор Е° 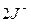 = + 0,54 В; ЭМ
= + 0,54 В; ЭМ